大学入学共通テスト(理科) 過去問
令和5年度(2023年度)本試験
問29 (化学基礎(第2問) 問1(b))
問題文
ある生徒は、「血圧が高めの人は、塩分の取りすぎに注意しなくてはいけない」という話を聞き、しょうゆに含まれる塩化ナトリウムNaClの量を分析したいと考え、文献を調べた。
文献の記述
水溶液中の塩化物イオンCl−の濃度を求めるには、指示薬として少量のクロム酸カリウムK2CrO4を加え、硝酸銀AgNO3水溶液を滴下する。水溶液中のCl−は、加えた銀イオンAg+と反応し塩化銀AgCLの白色沈殿を生じる。
Ag+の物質量がCl−と過不足なく反応するのに必要な量を超えると、(a)過剰なAg+とクロム酸イオンCrO42−が反応してクロム酸銀Ag2CrO4の暗赤色沈殿が生じる。したがって、滴下したAgNO3水溶液の量から、Cl−の物質量を求めることができる。
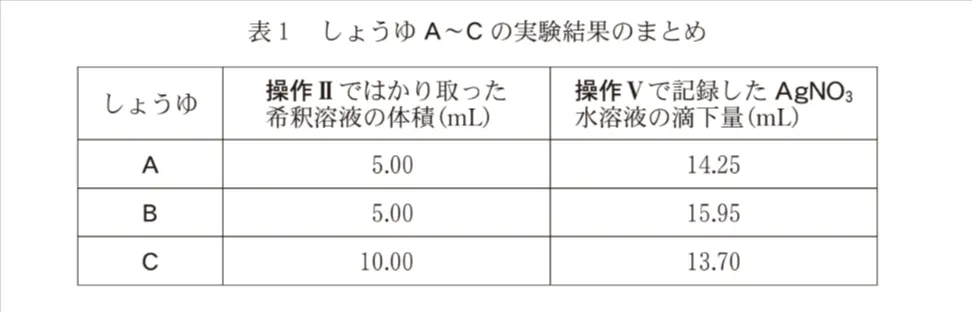
そこでこの生徒は、3種類の市販のしょうゆA~Cに含まれるCl−の濃度を分析するため、それぞれに次の操作Ⅰ~Ⅴを行い、表1に示す実験結果を得た。ただし、しょうゆにはCl−以外にAg+と反応する成分は含まれていないものとする。
操作Ⅰ ホールピペットを用いて、250mLのメスフラスコに5.00mLのしょうゆをはかり取り、標線まで水を加えて、しょうゆの希釈溶液を得た。
操作Ⅱ ホールピペットを用いて、操作Ⅰで得られた希釈溶液から一定量をコニカルビーカーにはかり取り、水を加えて全量を50mLにした。
操作Ⅲ 操作Ⅱのコニカルビーカーに少量のK2CrO4を加え、得られた水溶液を試料とした。
操作Ⅳ 操作Ⅲの試料に0.0200mol/LのAgNO3水溶液を滴下し、よく混ぜた。
操作Ⅴ 試料が暗赤色に着色して、よく混ぜてもその色が消えなくなるまでに要した滴下量を記録した。
下線部(a)に示したCrO42−に関する次の記述を読み、後の問いに答えよ。
この実験は水溶液が弱い酸性から中性の範囲で行う必要がある。強い酸性の水溶液中では、次の式(1)に従って、CrO42−から二クロム酸イオンCr2O72−が生じる。
( ア )CrO42−+( イ )H+ → ( ウ )Cr2O72−+H2O (1)
したがって、試料が強い酸性の水溶液である場合、CrO42−はCr2O72−に変化してしまい指示薬としてはたらかない。式(1)の反応では、クロム原子の酸化数は反応の前後で( エ )。
空欄( エ )に当てはまる記述として最も適当なものを、後の選択肢のうちから一つ選べ。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和5年度(2023年度)本試験 問29(化学基礎(第2問) 問1(b)) (訂正依頼・報告はこちら)
ある生徒は、「血圧が高めの人は、塩分の取りすぎに注意しなくてはいけない」という話を聞き、しょうゆに含まれる塩化ナトリウムNaClの量を分析したいと考え、文献を調べた。
文献の記述
水溶液中の塩化物イオンCl−の濃度を求めるには、指示薬として少量のクロム酸カリウムK2CrO4を加え、硝酸銀AgNO3水溶液を滴下する。水溶液中のCl−は、加えた銀イオンAg+と反応し塩化銀AgCLの白色沈殿を生じる。
Ag+の物質量がCl−と過不足なく反応するのに必要な量を超えると、(a)過剰なAg+とクロム酸イオンCrO42−が反応してクロム酸銀Ag2CrO4の暗赤色沈殿が生じる。したがって、滴下したAgNO3水溶液の量から、Cl−の物質量を求めることができる。
そこでこの生徒は、3種類の市販のしょうゆA~Cに含まれるCl−の濃度を分析するため、それぞれに次の操作Ⅰ~Ⅴを行い、表1に示す実験結果を得た。ただし、しょうゆにはCl−以外にAg+と反応する成分は含まれていないものとする。
操作Ⅰ ホールピペットを用いて、250mLのメスフラスコに5.00mLのしょうゆをはかり取り、標線まで水を加えて、しょうゆの希釈溶液を得た。
操作Ⅱ ホールピペットを用いて、操作Ⅰで得られた希釈溶液から一定量をコニカルビーカーにはかり取り、水を加えて全量を50mLにした。
操作Ⅲ 操作Ⅱのコニカルビーカーに少量のK2CrO4を加え、得られた水溶液を試料とした。
操作Ⅳ 操作Ⅲの試料に0.0200mol/LのAgNO3水溶液を滴下し、よく混ぜた。
操作Ⅴ 試料が暗赤色に着色して、よく混ぜてもその色が消えなくなるまでに要した滴下量を記録した。
下線部(a)に示したCrO42−に関する次の記述を読み、後の問いに答えよ。
この実験は水溶液が弱い酸性から中性の範囲で行う必要がある。強い酸性の水溶液中では、次の式(1)に従って、CrO42−から二クロム酸イオンCr2O72−が生じる。
( ア )CrO42−+( イ )H+ → ( ウ )Cr2O72−+H2O (1)
したがって、試料が強い酸性の水溶液である場合、CrO42−はCr2O72−に変化してしまい指示薬としてはたらかない。式(1)の反応では、クロム原子の酸化数は反応の前後で( エ )。
空欄( エ )に当てはまる記述として最も適当なものを、後の選択肢のうちから一つ選べ。

- +3から+6に増加する
- +6から+3に減少する
- 変化せず、どちらも+3である
- 変化せず、どちらも+6である
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
●CrO42-
CrO42-の分子全体での酸化数は-2
O4の酸化数は-2×4=-8
よってCrの酸化数は-2-(-8)=+6
●Cr2O72-
Cr2O72-の分子全体での酸化数は-2
O7の酸化数は-2×7=-14
Cr2の酸化数は-2-(-14)=+12
よってCrの酸化数は+12/2=+6
Crの酸化数は変化せず、どちらも+6です。
参考になった数0
この解説の修正を提案する
前の問題(問26)へ
令和5年度(2023年度)本試験 問題一覧
次の問題(問30)へ