大学入学共通テスト(理科) 過去問
令和4年度(2022年度)本試験
問105 (化学(第3問) 問3(b))
問題文
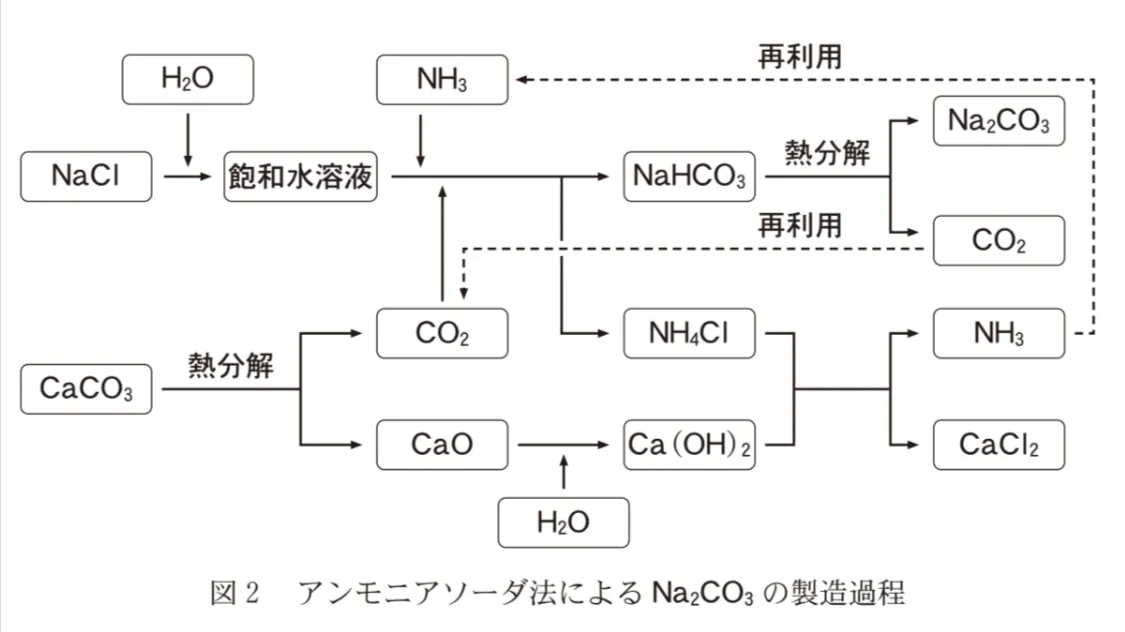
アンモニアソーダ法は、Na2CO3の代表的な製造法である。その製造過程を図2に示す。この方法には、NaHCO3の熱分解で生じるCO2,およびNH4ClとCa(OH)2の反応で生じるNH3をいずれも回収して、無駄なく再利用するという特徴がある。
アンモニアソーダ法に関する記述として誤りを含むものはどれか。最も適当なものを、次の選択肢のうちから一つ選べ。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)本試験 問105(化学(第3問) 問3(b)) (訂正依頼・報告はこちら)
アンモニアソーダ法は、Na2CO3の代表的な製造法である。その製造過程を図2に示す。この方法には、NaHCO3の熱分解で生じるCO2,およびNH4ClとCa(OH)2の反応で生じるNH3をいずれも回収して、無駄なく再利用するという特徴がある。
アンモニアソーダ法に関する記述として誤りを含むものはどれか。最も適当なものを、次の選択肢のうちから一つ選べ。

- NaHCO3の水への溶解度は、NH4Clより大きい。
- NaCl飽和水溶液にNH3を吸収させたあとにCO2を通じるのは、CO2を溶かしやすくするためである。
- 図2のそれぞれの反応は、触媒を必要としない。
- NaHCO3の熱分解によりNa2CO3が生成する過程では、CO2のほかに水も生成する。
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
「炭酸ナトリウム」の製法である「アンモニアソーダ法」についての問題です。
炭酸ナトリウムを工業的に得る(=反応が速い、材料が安価)ために考案された反応です。
NaHCO3は潮解性がありませんが、NH4Clは潮解性があります。
NH4Clのほうが水への溶解度が高いです。
よって、誤りを含む文章です。
この部分での反応はNaClaqにH2O、NH3、CO2を加えNaHCO3を得るのが目的です。
NaClaqにはNa+、Cl-が含まれます。
NH3、CO2はH2Oに溶かすと下式のように反応し、NH4+、OH-、HCO3-、H+を生じます。
H2O+NH3⇔NH4++OH- …① ※正反応逆反応どちらもおこる平衡反応です
H2O+CO2⇔HCO3-+H+ …② ※正反応逆反応どちらもおこる平衡反応です
Na+とHCO3-が反応することで目的のNa2CO3を得ます。
HCO3-がたくさん生成するほうが反応を速く進めることができます。
HCO3-が生成する反応①は平衡反応です。
①の平衡が右側に傾く状況(=CO2が溶けやすい)を作ると、目的の反応は早く進みます。
①の平衡を右側に傾けるには、同時に生成するH+が減っていく必要があります。
H+が消費されるように、CO2を加える前の液が、塩基性であればH+は消費されます。
先にNH3を溶かしておけば、OH-ができ液は塩基性となります。
よって、正しい文章です。
正しい文章です。
アンモニアソーダ法で起こる反応は、それぞれ反応性が高く触媒は不要です。
原料がNaHCO3、生成物がNa2CO3となる反応式を書いてみましょう。
2NaHCO3→Na2CO3+H2O+CO2
CO2と水が生じました。
よって、正しい文章です。
参考になった数0
この解説の修正を提案する
前の問題(問104)へ
令和4年度(2022年度)本試験 問題一覧
次の問題(問106)へ