大学入学共通テスト(理科) 過去問
令和4年度(2022年度)本試験
問106 (化学(第3問) 問3(c))
問題文
必要があれば,原子量は次の値を使うこと。
H 1.0 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ca 40
気体は、実在気体とことわりがない限り、理想気体として扱うものとする。
次の文章を読み、後の問いに答えよ。
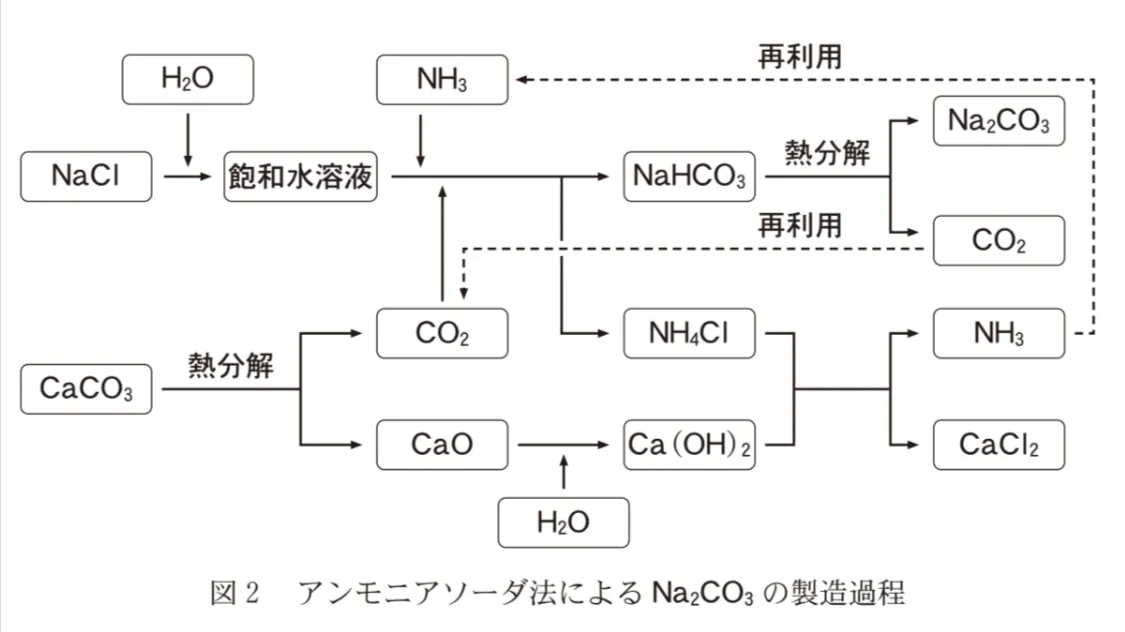
アンモニアソーダ法は、Na2CO3の代表的な製造法である。その製造過程を図2に示す。この方法には、NaHCO3の熱分解で生じるCO2,およびNH4ClとCa(OH)2の反応で生じるNH3をいずれも回収して、無駄なく再利用するという特徴がある。
NaCl 58.5kgがすべて反応してNa2CO3とCaCl2を生成するときに、最小限必要とされるCaCO3は何kgか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、この製造過程で生じるNH3およびCO2は、すべて再利用されるものとする。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)本試験 問106(化学(第3問) 問3(c)) (訂正依頼・報告はこちら)
必要があれば,原子量は次の値を使うこと。
H 1.0 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ca 40
気体は、実在気体とことわりがない限り、理想気体として扱うものとする。
次の文章を読み、後の問いに答えよ。
アンモニアソーダ法は、Na2CO3の代表的な製造法である。その製造過程を図2に示す。この方法には、NaHCO3の熱分解で生じるCO2,およびNH4ClとCa(OH)2の反応で生じるNH3をいずれも回収して、無駄なく再利用するという特徴がある。
NaCl 58.5kgがすべて反応してNa2CO3とCaCl2を生成するときに、最小限必要とされるCaCO3は何kgか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、この製造過程で生じるNH3およびCO2は、すべて再利用されるものとする。

- 25.0
- 50.0
- 100
- 200
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
CaCO3が何mol必要なのかが分かれば、その重量も分かります。
図を見ると、NaClとCaCO3それぞれを原料に
たくさんの反応が起こった結果Na2CO3とCaCl2が生成しています。
全ての反応について反応式を書き、何が何mol反応するのかを確認しましょう。
NaCl+H2O+NH3+CO2→NH4Cl+NaHCO3 …①
2NaHCO3→Na2CO3+CO2+H2O …②
CaCO3→CaO+CO2 …③
CaO+H2O→Ca(OH)2 …④
2NH4Cl+Ca(OH)2→CaCl2+2NH3+2H2O …⑤
これら①~⑤の式をひとつにまとめると以下の式になります。
2NaCl+CaCO3→Na2CO3+CaCl2
この式から、NaCl:CaCO3=2:1のmol比で反応することが分かりました。
NaCl(分子量58.5g/mol)は58.5kgあるため、58.5×1000/58.5=1000molあります
CaCO3はその1/2の割合で反応するため、1000mol/2=500mol必要です。
CaCO3(分子量100g/mol) 500molは100g/mol×500mol/1000=50kg
よって、答えは50kgになります。
①~⑤の式をひとつにまとめて考えましたが
まとめずに、NaCl 1molに対してCaCO3が何mol反応するか地道に考えても
答えを出すことはできます(時間はかかってしまいます)
参考になった数0
この解説の修正を提案する
前の問題(問105)へ
令和4年度(2022年度)本試験 問題一覧
次の問題(問107)へ