大学入学共通テスト(理科) 過去問
令和4年度(2022年度)本試験
問27 (化学基礎(第1問) 問10)
問題文
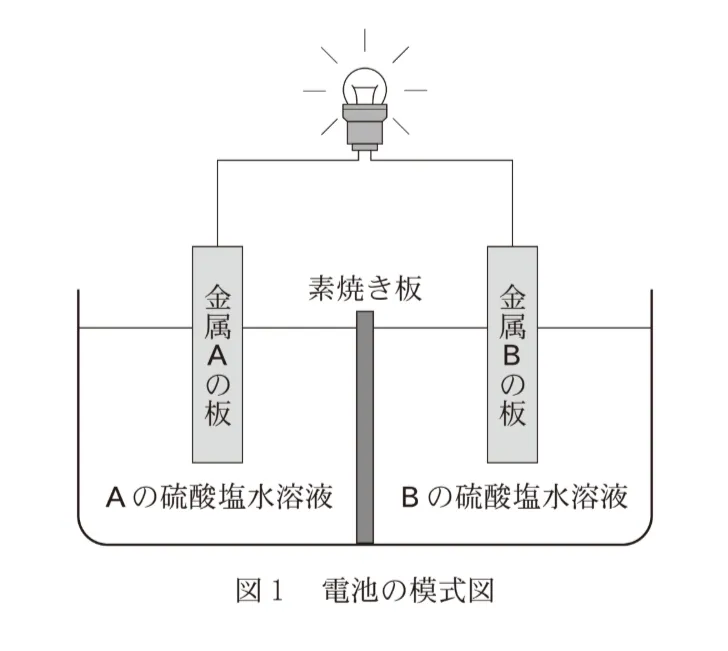
金属Aの板を入れたAの硫酸塩水溶液と、金属Bの板を入れたBの硫酸塩水溶液を素焼き板で仕切って作製した電池を図1に示す。素焼き板は、両方の水溶液が混ざるのを防ぐが、水溶液中のイオンを通すことができる。この電池の全体の反応は、式(2)によって表される。
A+B2+ → A2++B ・・・・・(2)
この電池に関する記述として誤りを含むものはどれか。最も適当なものを、後の選択肢のうちから一つ選べ。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)本試験 問27(化学基礎(第1問) 問10) (訂正依頼・報告はこちら)
金属Aの板を入れたAの硫酸塩水溶液と、金属Bの板を入れたBの硫酸塩水溶液を素焼き板で仕切って作製した電池を図1に示す。素焼き板は、両方の水溶液が混ざるのを防ぐが、水溶液中のイオンを通すことができる。この電池の全体の反応は、式(2)によって表される。
A+B2+ → A2++B ・・・・・(2)
この電池に関する記述として誤りを含むものはどれか。最も適当なものを、後の選択肢のうちから一つ選べ。

- 金属Aの板は負極としてはたらいている。
- 2molの金属Aが反応したときに、1molの電子が電球を流れる。
- 反応によって、B2+が還元される。
- 反応の進行にともない、金属Aの板の質量は減少する。
正解!素晴らしいです
残念...

この過去問の解説 (2件)
01
Aが電子を出す(酸化)、B²⁺が電子をもらう(還元)反応です。
金属Aは電子を出しているため、負極です。
したがって、正解です。
A → A2+ + 2e-
となります。
式より、1molの金属Aが反応したときに、2molの電子が電球を流れることがわかります。つまり、2molの金属Aが反応すると、4molの電子が電球を流れます。
したがって、不正解です。
B²⁺が電子をもらって、Bになります。
したがって、正解です。
Aが溶けて、A2+になります。
したがって、正解です。
参考になった数0
この解説の修正を提案する
02
「電池」に関する問題です。
金属が分解してイオン化する際に放出される電子e-が液体の中を通って循環することで電気が流れます。
〇正極、負極の定義を覚えておきましょう。
・正極:電子e-を受け取る、還元反応が起こる
・負極:電子e-を放出する、酸化反応が起こる
次の2通りの考え方ができます。
・電子を放出するor受け取る
電子の動きを確認するために、A・Bそれぞれの反応式を書きます。
A→A2++2e-
B2++2e-→B
Aは電子を放出しているため負極として働いていると判断できます。
・酸化or還元
A、Bそれぞれの酸化数の変化を見ます。
A:0→2
B:2→0
Aは酸化数が増えているため、酸化しています。
よってAは負極として働いていると判断できます。
電子の動きもいれたAの反応式を書くと以下のようになります。
A→A2++2e-
この式より、Aが1molが反応すると、電子e-は2mol放出されることが分かります。
Aが2mol反応すると、電子e-は4mol反応することになります。
よって間違いです。
酸化・還元の見分けポイントは4つです。
還元される場合は以下のことが起こります。
・酸素原子を失う
・水素原子を受け取る
・電子を受け取る
・酸化数が減る
電子の動きもいれたBの反応式を書くと以下のようになります。
B2++2e-→B
B2+は電子を受け取るため、還元されていると判断できます。
また、酸化数は2→0で減少しているため、還元されていると判断できます。
式より、Aは反応の進行に伴い分解してA2+に変化します。
イオンとなって水溶液中を移動したり、金属Bに析出したりするため
金属Aの板の重量は減少します。
参考になった数0
この解説の修正を提案する
前の問題(問26)へ
令和4年度(2022年度)本試験 問題一覧
次の問題(問28)へ