大学入学共通テスト(理科) 過去問
令和4年度(2022年度)本試験
問95 (化学(第1問) 問5(b))
問題文
空気の水への溶解は、水中生物の呼吸(酸素の溶解)やダイバーの減圧症(溶解した窒素の遊離)などを理解するうえで重要である。1.0✕105PaのN2とO2の溶解度(水1Lに溶ける気体の物質量)の温度変化をそれぞれ図1に示す。N2とO2の水への溶解に関する後の問いに答えよ。ただし、N2とO2の水への溶解は、ヘンリーの法則に従うものとする。
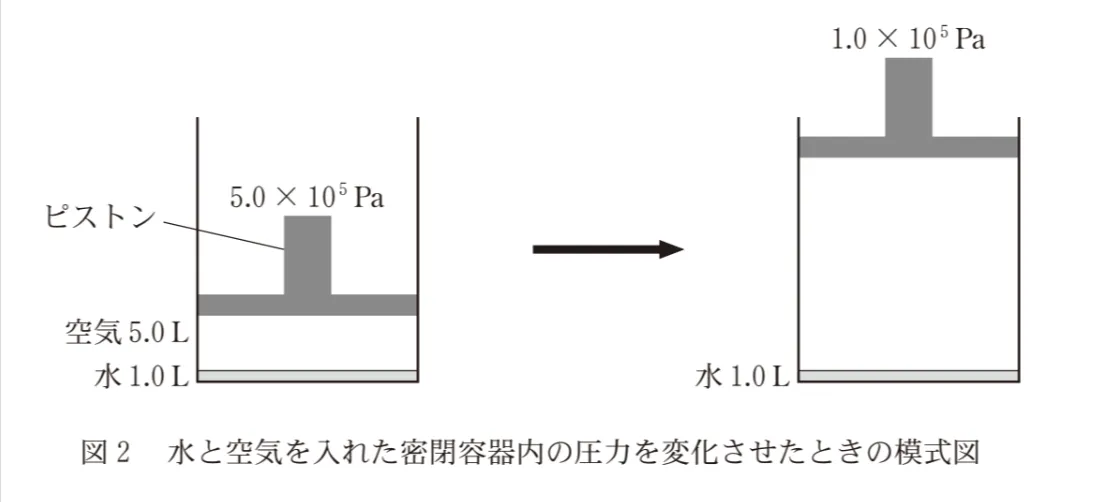
図2に示すように、ピストンの付いた密閉容器に水と空気(物質量比N2:O2=4:1)を入れ、ピストンに5.0✕105Paの圧力を加えると、20℃で水および空気の体積はそれぞれ1.0L、5.0Lになった。次に、温度を一定に保ったままピストンを引き上げ、圧力を1.0✕105Paにすると、水に溶解していた気体の一部が遊離した。このとき、遊離したN2の体積は0℃、1.013✕105Paのもとで何mLか。最も近い数値を、後の選択肢のうちから一つ選べ。ただし、気体定数はR=8.31✕103Pa・L/(K・mol)とする。また、密閉容器内の空気のN2とO2の物質量比の変化と水の蒸気圧は、いずれも無視できるものとする。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)本試験 問95(化学(第1問) 問5(b)) (訂正依頼・報告はこちら)
空気の水への溶解は、水中生物の呼吸(酸素の溶解)やダイバーの減圧症(溶解した窒素の遊離)などを理解するうえで重要である。1.0✕105PaのN2とO2の溶解度(水1Lに溶ける気体の物質量)の温度変化をそれぞれ図1に示す。N2とO2の水への溶解に関する後の問いに答えよ。ただし、N2とO2の水への溶解は、ヘンリーの法則に従うものとする。
図2に示すように、ピストンの付いた密閉容器に水と空気(物質量比N2:O2=4:1)を入れ、ピストンに5.0✕105Paの圧力を加えると、20℃で水および空気の体積はそれぞれ1.0L、5.0Lになった。次に、温度を一定に保ったままピストンを引き上げ、圧力を1.0✕105Paにすると、水に溶解していた気体の一部が遊離した。このとき、遊離したN2の体積は0℃、1.013✕105Paのもとで何mLか。最も近い数値を、後の選択肢のうちから一つ選べ。ただし、気体定数はR=8.31✕103Pa・L/(K・mol)とする。また、密閉容器内の空気のN2とO2の物質量比の変化と水の蒸気圧は、いずれも無視できるものとする。

- 13
- 16
- 50
- 63
- 78
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
圧力が高いほど気体の溶解度は大きくなります。(ヘンリーの法則)
この問題では、圧力を5.0×105Paから1.0×105Paに下げたために
気体(物質量比N2:O2=4:1)の一部が溶けきれなくなり遊離しています。
溶けきれなくなったN2の体積を問われています。
圧力を変える前後での、水に溶けているN2の量の差を求めます。
●圧力1.0×105Paのとき
グラフより、圧力が1.0×105Paのときは水1LにN2が0.7×10-3mol溶けます。
この問題で密閉容器内の気体はN2:O2=4:1の混合気体です。
よって、N2の圧力(分圧)は1.0×105×4/5になります。
水1Lに溶けているN2の物質量=0.7×10-3mol×4/5=0.56×10-3mol
●圧力5.0×105Paのとき
圧力が5倍のため水1Lに溶けているN2の物質量も5倍です。
水1Lに溶けているN2の物質量=0.56×10-3mol×5=2.8×10-3mol
溶けきれなくなったN2の物質量=(2.8×10-3mol)-(0.56×10-3mol)
=2.24×10-3mol
問われているのは、標準状態(0℃、1.013×105Pa)でのこのN2の体積です。
標準状態では気体1mol=22.4L=22400mlです。
よって答えは、22400ml/mol×2.24×10-3mol=50.17ml
参考になった数0
この解説の修正を提案する
前の問題(問94)へ
令和4年度(2022年度)本試験 問題一覧
次の問題(問96)へ