大学入学共通テスト(理科) 過去問
令和4年度(2022年度)本試験
問101 (化学(第2問) 問4(c))
問題文
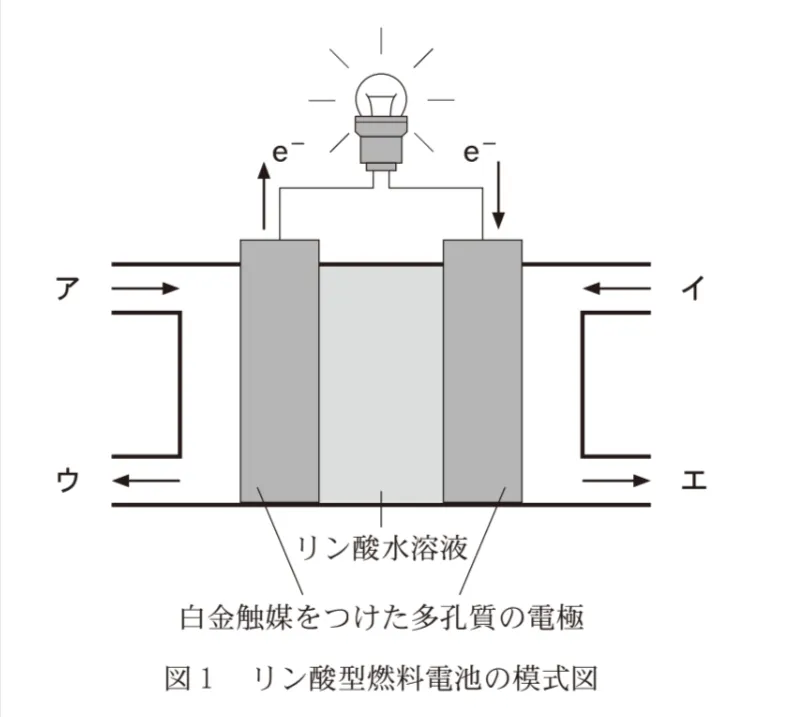
化石燃料に代わる新しいエネルギー源の一つとして水素H2がある。H2の貯蔵と利用に関する次の問いに答えよ。
図1の燃料電池でH22.00mol、O21.00molが反応したとき、外部回路に流れた電気量は何Cか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、ファラデー定数は9.65✕104C/molとし、電極で生じた電子はすべて外部回路を流れたものとする。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)本試験 問101(化学(第2問) 問4(c)) (訂正依頼・報告はこちら)
化石燃料に代わる新しいエネルギー源の一つとして水素H2がある。H2の貯蔵と利用に関する次の問いに答えよ。
図1の燃料電池でH22.00mol、O21.00molが反応したとき、外部回路に流れた電気量は何Cか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、ファラデー定数は9.65✕104C/molとし、電極で生じた電子はすべて外部回路を流れたものとする。

- 1.93✕104
- 9.65✕104
- 1.93✕105
- 3.86✕105
- 7.72✕105
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
この電池の反応式を書いて、流れた電気量を求めます。
リン酸型燃料電池の反応式はこちらです。
負極:H2→2H++2e-
正極:4H++4e-+O2→2H2O
どちらの式で計算してもよいですが
負極の式で計算すると
H2が2.00mol反応するため、e-は2.00×2=4.00mol発生します。
正極の式で計算すると
O2が1.00mol反応するため、e-は1.00×4=4.00mol発生します。
e- 1molの電気量を表したのがファラデー定数です。
よって、4.00molのe-がもつ電気量は
4.00mol×9.65×104C/mol=3.86×105Cになります。
参考になった数0
この解説の修正を提案する
前の問題(問100)へ
令和4年度(2022年度)本試験 問題一覧
次の問題(問102)へ