大学入学共通テスト(理科) 過去問
令和4年度(2022年度)追・再試験
問102 (化学(第2問) 問4(a))
問題文
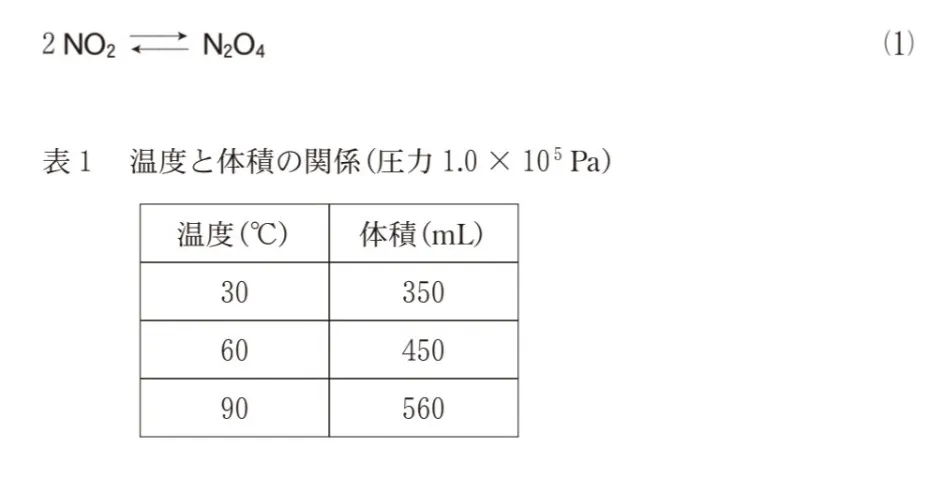
ピストンの付いた密閉容器に2.0✕10-2molのNO2を入れ、圧力1.0✕105Paのもとで温度を変えて平衡に達したときの体積を測定した。30℃、60℃、90℃での測定結果を表1に示す。表1から、温度が上昇すると平衡が( ア )に移動したことがわかる。
また、NO2からN2O4が生成する反応(式(1)の正反応)は、( イ )反応であることがわかる。後の問いに答えよ。
ただし、気体定数はR=8.3✕103Pa・L/(K・mol)とする。
a 空欄( ア )・( イ )に当てはまる語の組合せとして最も適当なものを、次の選択肢のうちから一つ選べ。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)追・再試験 問102(化学(第2問) 問4(a)) (訂正依頼・報告はこちら)
ピストンの付いた密閉容器に2.0✕10-2molのNO2を入れ、圧力1.0✕105Paのもとで温度を変えて平衡に達したときの体積を測定した。30℃、60℃、90℃での測定結果を表1に示す。表1から、温度が上昇すると平衡が( ア )に移動したことがわかる。
また、NO2からN2O4が生成する反応(式(1)の正反応)は、( イ )反応であることがわかる。後の問いに答えよ。
ただし、気体定数はR=8.3✕103Pa・L/(K・mol)とする。
a 空欄( ア )・( イ )に当てはまる語の組合せとして最も適当なものを、次の選択肢のうちから一つ選べ。

- ア:左向き イ:発熱
- ア:左向き イ:吸熱
- ア:右向き イ:発熱
- ア:右向き イ:吸熱
正解!素晴らしいです
残念...

この過去問の解説 (2件)
01
表1から、1.0×105Paのもとでは絶対温度が303Kから333Kに上昇すると、体積は450/350倍になることが読み取れます。
このとき、体積の変化は約1.29倍なのに対し、絶対温度の変化は約1.01倍となっています。
つまり絶対温度の変化より体積の変化の方が大きいので、気体の物質量は増加し、それに伴って分子数も増加します。
よって平衡は左向きになることが分かります。
(これは絶対温度が333Kから363Kへ上昇したときにも同様のことがいえます)。
また、このことからルシャトリエの原理より、温度が上昇すると逆反応(吸熱反応)が進むので、正反応が発熱反応であるといえます。
以上のことから、空欄ア・イに当てはまる語の組合せとして最も適当なのは、左向き・発熱ということが分かります。
参考になった数0
この解説の修正を提案する
02
温度の上昇とともに反応が進んで体積が増えたということは、
気体分子の数も増えたということです。
そのため、(ア)の答えは分子の数が多い左辺へ向かう左向きです。
またこのことから、温度を下げるほどこの反応の正反応が進むことになるので
これはルシャトリエの原理から発熱反応だとわかります。
気体の平衡の問題では、両辺の分子の数に注目しましょう。
またルシャトリエの原理から発熱反応か吸熱反応か判断できるようになりましょう。
参考になった数0
この解説の修正を提案する
前の問題(問101)へ
令和4年度(2022年度)追・再試験 問題一覧
次の問題(問103)へ