大学入学共通テスト(理科) 過去問
令和4年度(2022年度)追・再試験
問111 (化学(第3問) 問3(c))
問題文
マグネシウムMgは陽イオンになりやすく、その単体は強い還元剤としてはたらく。たとえば、単体のMgの固体と塩化銀AgClの固体を適切な条件下で反応させると、AgClが還元され、単体の銀Agと塩化マグネシウムMgCl2が生じる。また、単体のMgとAgClを用いて、電池をつくることができる。単体のMgによるAgClの還元反応に関して、次の実験Ⅰ・Ⅱを行った。
実験Ⅰ
0.12gの単体のMg粉末と過剰量のAgCL粉末を、急激に反応しないよう注意しながら十分に反応させたところ、単体のAg,MgCl2,未反応のAgClのみからなる混合物が得られた。MgCl2が水溶性であること、およびAgClがある液体に溶ける性質を利用して、この混合物から単体のAgを取り出した。
実験Ⅱ
単体のMgによるAgClの還元反応を利用した、食塩水を電解液とする電池の反応は、次の式(1)、(2)によって表される。
正極 AgCl+e- → Ag+Cl- (1)
負極 Mg → Mg2++2e- (2)
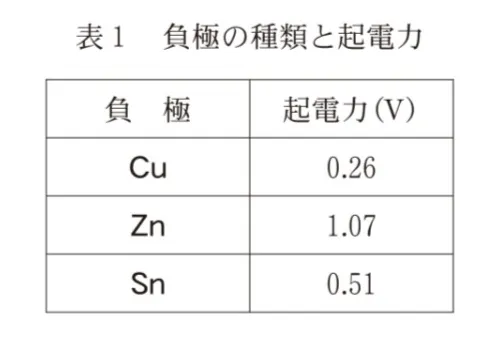
この電池の負極を、単体のCu,Zn,Snにかえた電池を組み立てて、これらの起電力を測定すると、表1の結果が得られた。
c 単体のMgを負極として用いた電池の起電力をx(V)とする。表1と金属のイオン化傾向から考えられる、xを含む範囲として最も適当なものを、次の選択肢のうちから一つ選べ。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)追・再試験 問111(化学(第3問) 問3(c)) (訂正依頼・報告はこちら)
マグネシウムMgは陽イオンになりやすく、その単体は強い還元剤としてはたらく。たとえば、単体のMgの固体と塩化銀AgClの固体を適切な条件下で反応させると、AgClが還元され、単体の銀Agと塩化マグネシウムMgCl2が生じる。また、単体のMgとAgClを用いて、電池をつくることができる。単体のMgによるAgClの還元反応に関して、次の実験Ⅰ・Ⅱを行った。
実験Ⅰ
0.12gの単体のMg粉末と過剰量のAgCL粉末を、急激に反応しないよう注意しながら十分に反応させたところ、単体のAg,MgCl2,未反応のAgClのみからなる混合物が得られた。MgCl2が水溶性であること、およびAgClがある液体に溶ける性質を利用して、この混合物から単体のAgを取り出した。
実験Ⅱ
単体のMgによるAgClの還元反応を利用した、食塩水を電解液とする電池の反応は、次の式(1)、(2)によって表される。
正極 AgCl+e- → Ag+Cl- (1)
負極 Mg → Mg2++2e- (2)
この電池の負極を、単体のCu,Zn,Snにかえた電池を組み立てて、これらの起電力を測定すると、表1の結果が得られた。
c 単体のMgを負極として用いた電池の起電力をx(V)とする。表1と金属のイオン化傾向から考えられる、xを含む範囲として最も適当なものを、次の選択肢のうちから一つ選べ。

- x<0.26
- 0.26<x<0.51
- 0.51<x<1.07
- 1.07<x
正解!素晴らしいです
残念...

この過去問の解説 (1件)
01
この問題は金属イオン化傾向を理解しているかがポイントになります。
金属のイオン化傾向では
Mg>Zn>Sn>Cu
となり、負極で用いる金属イオン化傾向の差が大きいほど起電力が大きくなります。
よってMgを負極で用いたときの起電力は、Znの場合よりも大きくなると考えることができますから、Xを含む範囲として最も適当なものは、1.07<Xということが分かります。
参考になった数0
この解説の修正を提案する
前の問題(問110)へ
令和4年度(2022年度)追・再試験 問題一覧
次の問題(問112)へ