大学入学共通テスト(理科) 過去問
令和6年度(2024年度)本試験
問113 (化学(第5問) 問3)
問題文
必要があれば、原子量は次の値を使うこと。
H 1.0 Li 6.9 C 12 N 14 O 16 S 32 Cl 35.5 Mn 55 Ni 59
Cu 64 Zn 65 Ag 108
気体は、実在気体とことわりがない限り、理想気体として扱うものとする。
質量分析法に関する次の文章を読み、後の問いに答えよ。
質量分析法では、(a)きわめて微量な成分を分析することができる。この方法では、真空中で原子や分子をイオン化した後、電気や磁気の力を利用して(b)イオンを質量ごとに分離し、これを検出することで、イオン化した原子や分子の個数を知ることができる。
イオンの質量(12C原子の質量を12とした「相対質量」)に対して、検出したそのイオンの個数(またはその最大値を100とした相対値で表した「相対強度」)をグラフにしたものを質量スペクトルという。
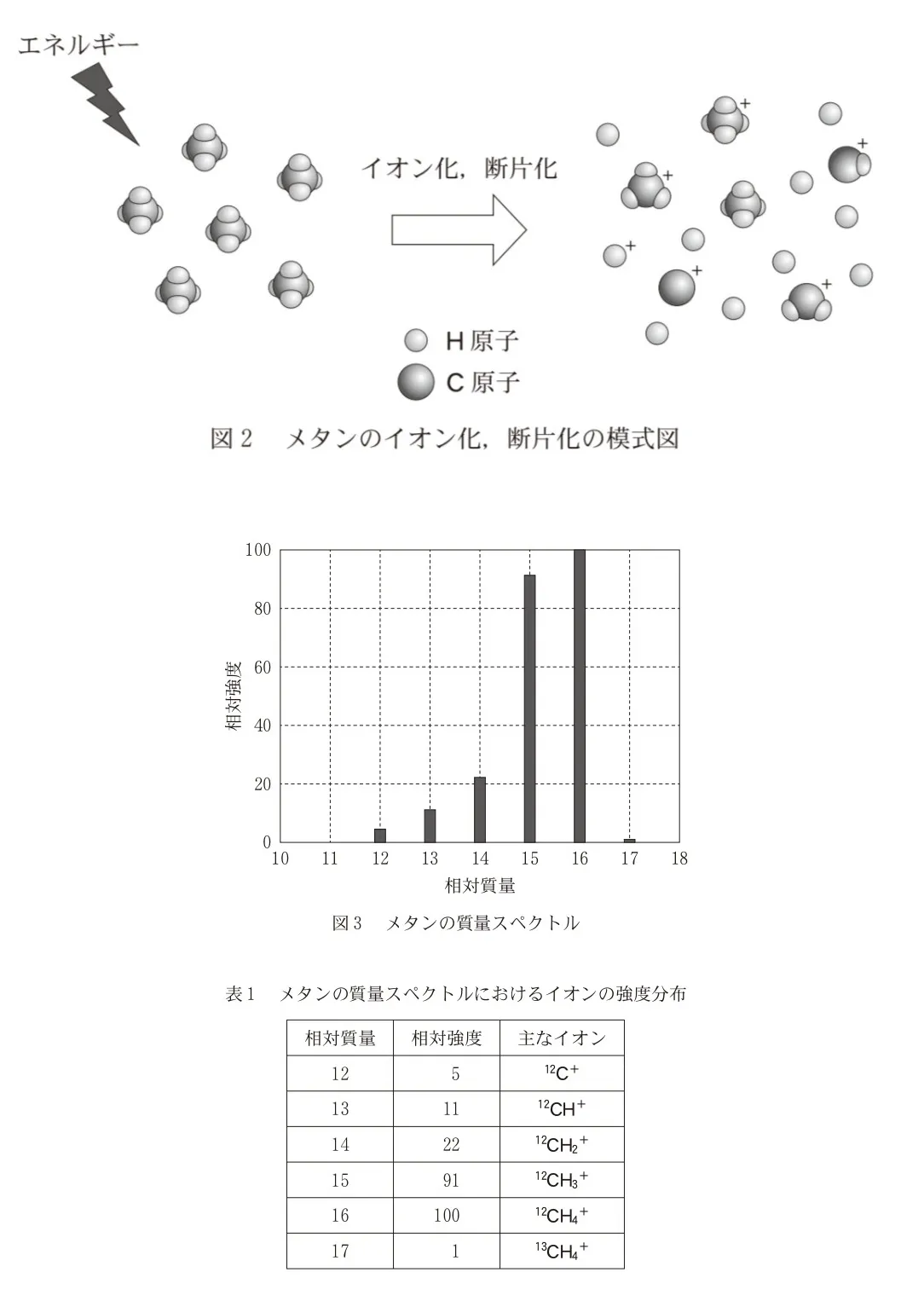
図2は、メタンCH4を例としたイオン化の模式図である。外部から大きなエネルギーを与えると、CH4から電子が放出され、CH4+が生成する。与えられるエネルギーがさらに大きいと、CH4+の結合が切断されたCH3+やCH2+などが生成することもある。
CH4をあるエネルギーでイオン化したときの質量スペクトルを図3に、相対質量12~17のイオンの相対強度を表1に示す。相対質量が17のイオンは、天然に1%存在する13CH4に由来する13CH4+である。CH4+のような、電子を放出しただけのイオンを「分子イオン」、CH3+やCH2+のような結合が切断されたイオンを「断片イオン」とよぶ。
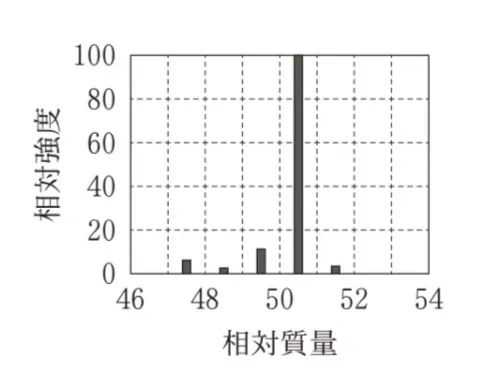
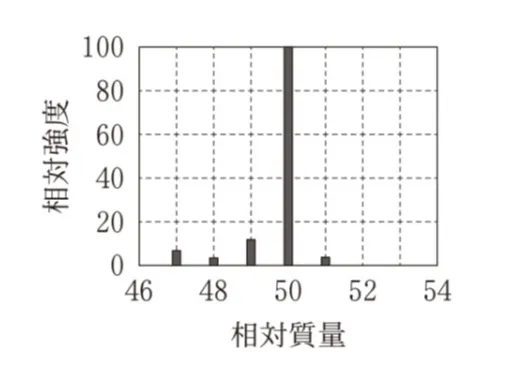
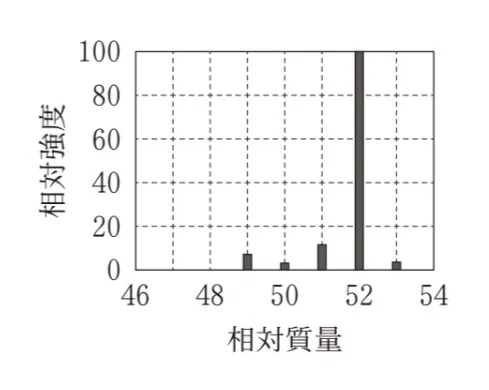
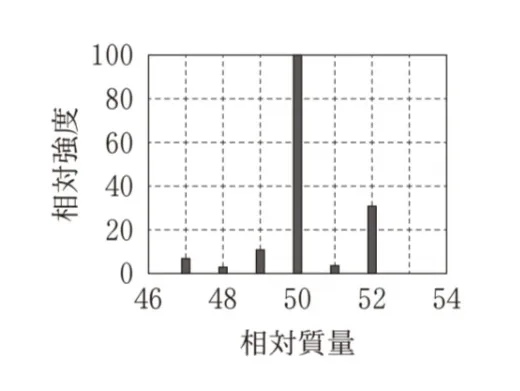
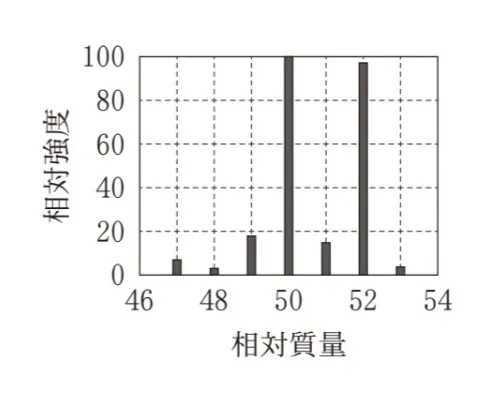
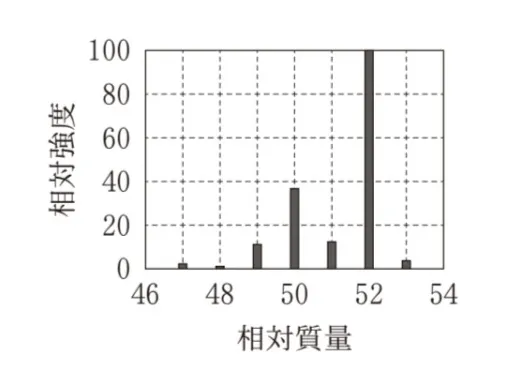
塩素Clには2種の同位体35Clと37Clがあり、それらは天然におよそ3:1の割合で存在する。図3と同じエネルギーでクロロメタンCH3Clをイオン化した場合の、相対質量が50付近の質量スペクトルはどれか。最も適当なものを、次の選択肢のうちから一つ選べ。ただし、35Clと37Clの相対質量は、それぞれ35、37とする。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和6年度(2024年度)本試験 問113(化学(第5問) 問3) (訂正依頼・報告はこちら)
必要があれば、原子量は次の値を使うこと。
H 1.0 Li 6.9 C 12 N 14 O 16 S 32 Cl 35.5 Mn 55 Ni 59
Cu 64 Zn 65 Ag 108
気体は、実在気体とことわりがない限り、理想気体として扱うものとする。
質量分析法に関する次の文章を読み、後の問いに答えよ。
質量分析法では、(a)きわめて微量な成分を分析することができる。この方法では、真空中で原子や分子をイオン化した後、電気や磁気の力を利用して(b)イオンを質量ごとに分離し、これを検出することで、イオン化した原子や分子の個数を知ることができる。
イオンの質量(12C原子の質量を12とした「相対質量」)に対して、検出したそのイオンの個数(またはその最大値を100とした相対値で表した「相対強度」)をグラフにしたものを質量スペクトルという。
図2は、メタンCH4を例としたイオン化の模式図である。外部から大きなエネルギーを与えると、CH4から電子が放出され、CH4+が生成する。与えられるエネルギーがさらに大きいと、CH4+の結合が切断されたCH3+やCH2+などが生成することもある。
CH4をあるエネルギーでイオン化したときの質量スペクトルを図3に、相対質量12~17のイオンの相対強度を表1に示す。相対質量が17のイオンは、天然に1%存在する13CH4に由来する13CH4+である。CH4+のような、電子を放出しただけのイオンを「分子イオン」、CH3+やCH2+のような結合が切断されたイオンを「断片イオン」とよぶ。
塩素Clには2種の同位体35Clと37Clがあり、それらは天然におよそ3:1の割合で存在する。図3と同じエネルギーでクロロメタンCH3Clをイオン化した場合の、相対質量が50付近の質量スペクトルはどれか。最も適当なものを、次の選択肢のうちから一つ選べ。ただし、35Clと37Clの相対質量は、それぞれ35、37とする。

正解!素晴らしいです
残念...

この過去問の解説
前の問題(問112)へ
令和6年度(2024年度)本試験 問題一覧
次の問題(問114)へ