大学入学共通テスト(理科) 過去問
令和4年度(2022年度)追・再試験
問36 (化学基礎(第2問) 問2(2))
問題文
必要があれば、原子量は次の値を使うこと。
H 1.0 C 12 O 16 Ne 20 Na 23 Mg 24 Cl 35.5 Ca 40
18世紀の後半から、化学の基本法則が次々と発見され、物質に対する理解が深まった。化学の基本法則を利用して原子量を求める実験と、原子量を利用して物質の組成を求める実験に関する次の問いに答えよ。
プルーストは、一つの化合物を構成している成分元素の質量の比は、常に一定であるという定比例の法則を提唱した。次の実験Ⅱは、炭酸ストロンチウムSrCO3を強熱すると、次の式(1)に示すように、固体の酸化ストロンチウムSrOと二酸化炭素CO2に分解することを利用して、ストロンチウムSrの原子量を求めることを目的としたものである。
SrCO3→SrO+CO2 (1)
実験Ⅱ
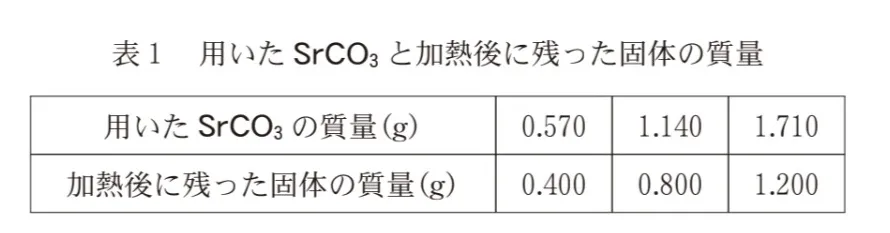
細かくすりつぶしたSrCO3をはかりとり、十分な時間強熱した。用いたSrCO3の質量と加熱後に残った固体の質量との関係は、表1のようになった。
式(1)の反応では、分解するSrCO3と生じるSrOの質量の( ウ )は、発生するCO2の質量に等しい。
また、生じるSrOとCO2の質量の( エ )は、分解するSrCO3の量にかかわらず一定となる。したがって、炭素Cと酸素Oの原子量を用いて、Srの原子量を求めることができる。
b 実験Ⅱの結果から求められるSrの原子量はいくらか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、加熱によりすべてのSrCO3が反応したものとする。
このページは閲覧用ページです。
履歴を残すには、 「新しく出題する(ここをクリック)」 をご利用ください。
問題
大学入学共通テスト(理科)試験 令和4年度(2022年度)追・再試験 問36(化学基礎(第2問) 問2(2)) (訂正依頼・報告はこちら)
必要があれば、原子量は次の値を使うこと。
H 1.0 C 12 O 16 Ne 20 Na 23 Mg 24 Cl 35.5 Ca 40
18世紀の後半から、化学の基本法則が次々と発見され、物質に対する理解が深まった。化学の基本法則を利用して原子量を求める実験と、原子量を利用して物質の組成を求める実験に関する次の問いに答えよ。
プルーストは、一つの化合物を構成している成分元素の質量の比は、常に一定であるという定比例の法則を提唱した。次の実験Ⅱは、炭酸ストロンチウムSrCO3を強熱すると、次の式(1)に示すように、固体の酸化ストロンチウムSrOと二酸化炭素CO2に分解することを利用して、ストロンチウムSrの原子量を求めることを目的としたものである。
SrCO3→SrO+CO2 (1)
実験Ⅱ
細かくすりつぶしたSrCO3をはかりとり、十分な時間強熱した。用いたSrCO3の質量と加熱後に残った固体の質量との関係は、表1のようになった。
式(1)の反応では、分解するSrCO3と生じるSrOの質量の( ウ )は、発生するCO2の質量に等しい。
また、生じるSrOとCO2の質量の( エ )は、分解するSrCO3の量にかかわらず一定となる。したがって、炭素Cと酸素Oの原子量を用いて、Srの原子量を求めることができる。
b 実験Ⅱの結果から求められるSrの原子量はいくらか。最も適当な数値を、次の選択肢のうちから一つ選べ。ただし、加熱によりすべてのSrCO3が反応したものとする。

- 76
- 80
- 88
- 96
- 104
- 120
正解!素晴らしいです
残念...

この過去問の解説 (3件)
01
実験Ⅱより読み取れるのは、用いたSrCO₃と加熱後に残った固体の質量(この場合SrO)とCO₂の質量には規則性があるということです。
例えば用いたSrCO₃の質量が0.570gの場合、生じたSrOは表1より0.400gということになりますので、CO₂は0.570gー0.400g=0.170g生じていることになります。
ここでSrの原子量をxとすると、式⑴の反応から分かるようにSrOとCO₂の物質量の比は1:1となるから
0.400g/(x+16)g=0.170g/44g
これをxについて解くと、x=87.5となり、選択肢の中からSrの原子量は88となることが分かります。
参考になった数0
この解説の修正を提案する
02
CO₂の質量は、表1より以下のようにまとまります。
CO₂の質量
=SrCO₃の質量−SrOの質量
=0.570g−0.400g
=0.170 g
次に、CO₂の物質量を求めます。
CO₂の物質量
=0.170g÷44g/mol
=3.86×10−3mol
式(1)より、SrOの物質量はCO₂の物質量と等しくなります。したがって、SrOの物質量は3.86×10−3molです。
SrOのモル質量を求めます。
SrOのモル質量
=0.400g÷3.86×10−3mol
=104g/mol
モル質量=原子量なので、SrOの原子量は104です。したがって、Srの原子量は以下のように求まります。
Srの原子量
=SrOの原子量-Oの原子量
=104-16
=88
参考になった数0
この解説の修正を提案する
03
SrCO3→SrO+CO2
この反応式について、不明なSrの原子量をXとすると
SrCO3の分子量は60+X、SrOの分子量は16+Xと表すことができます。
問題文より、今回の実験ではすべてのSrCO3が反応しているので
SrCO3とSrOのモル比は1:1であることがわかります。
CO2は気体のため、加熱後に残った固体=SrOです。
SrCO3のモル数:SrOのモル数=1:1のため
0.570/(60+X):0.400/(16+X)=1:1 という式が成り立ちます。
この式を解くと
0.57X+9.12=0.4X+24
0.17X=14.88
X≒87.53
よって答えは88です。
参考になった数0
この解説の修正を提案する
前の問題(問35)へ
令和4年度(2022年度)追・再試験 問題一覧
次の問題(問37)へ